
鳥学通信 top に戻る


日本鳥学会・津戸基金シンポジウム「世界と日本の水田における鳥類保全の課題」
津戸基金シンポジウムとは
津戸基金は、1987年に日本鳥学会会員津戸英守氏が日本の鳥学発展のためにご寄付された寄付金を運用するために設立されたものです。覚書(日鳥誌 37(4):254)により日本鳥学会が主催する鳥学シンポジウム開催の助成に充てられています。当初は毎年のように開かれていましたが、利子収入の低下などにより長らく(たぶん1997年を最後に)開催されていませんでした。しかし、一般寄付金から繰り入れることにより、今年度より隔年で10万円までを助成することになりました。今回の津戸基金シンポジウムは、こうした新しいスタイルでの第1回目にあたります。
企画概要
今回のシンポジウムを企画したきっかけは、約1ヵ月前にスペインのバルセロナで開かれたWaterbird Societyの年次総会です。そこでは「Rice and Waterbirds: Science, Management, and Conservation」と題したシンポジウムが開かれ、水田を利用する鳥や利用内容、保全上の問題などについて世界中から計16本の発表(他に関連ポスター2本)があり、また、関係者が集まって非公式のラウンドテーブル・ディスカッションが持たれました。日本からは農環研の天野さんと私がそれぞれ共同研究者との成果を発表しました。このシンポジウムはアメリカの研究者が企画したのですが、やはり水田の本場であるアジアがもっとリーダーシップを発揮すべきだということもあって、今回の津戸基金シンポを企画したわけです。
 |
| 写真1.シンポジウム演者紹介. |
 |
| 写真2.シンポジウム会場の様子. |
日時や場所から、発表者も含めて40人程度の参加者を見込んでいましたが、参加者名簿によると53名(会員24名、非会員29名)の参加をいただき、用意した会場にはほどほどの人数でした(写真2)。前半は私自身も含めて発表者や聴衆もやや緊張気味だったものの、休憩をはさんだ後半には活発に質問が出るようになりました。Lee 博士には通訳なしの英語で発表してもらいましたが、長らくアメリカにおられただけのことはあって、大変流暢でクリアな英語を話されたので、会場の皆さんも十分理解できたものと思います。
 |
| 写真3.懇親会風景. |
私は筑波大の教員とはいえ、ふだんは静岡市の山奥に勤務していることもあり、会場関係でもいろいろ不手際もありましたが、優秀な学生が助けてくれました。また、Lee さんと呉地さんはそれぞれ韓国と宮城県から来てくださいました。天野さんは発表だけでなく、午前中に Lee さんと私を水田ドライブに連れて行ってくれました。これらの方々と、司会を務めてくれた吉田さん、質疑応答の通訳をしてくれた百瀬さん、そして参加者の皆さんにこの場をお借りしてお礼申し上げます。
発表要旨の要旨
1. 鳥類の研究と保全にとってなぜ水田は重要なのか (藤岡正博 [筑波大学])
 |
| 写真4.シンポコンビナーの藤岡氏(筑波大)による趣旨説明. |
2. 水田地帯の鳥類生息地としての機能 (天野達也 [農業環境技術研究所])
 |
| 写真5.天野氏(農環研)による講演. |
利根川流域の水田景観32区画で越冬期と繁殖期に出現する鳥類の調査と環境分析を行った。農地性水鳥は繁殖期には水田面積の広い区画で多くの種が見られたが、越冬期には開放水面の広い区画で多く観察された。草地性鳥類や林縁性鳥類は、放棄田や森林など多様な環境を含む区画で多くの種が記録されるなど、生息地として利用される景観要素は季節間やグループ間で異なること、また種によっては複数の景観要素の存在が重要であることが示唆された。
・水田におけるチュウサギの食物探索経路
空間的に不均一な環境の中で動物の個体がどのように分布を決定しているかは生態学でも中心的なテーマの一つである。本研究では、主に水田で水生生物を採食するチュウサギ個体を詳細に追跡することにより、採食個体の食物探索経路を明らかにし、そこに関わる意思決定について考察を行う。
3. 冬期湛水による水田の鳥類生息地機能の向上 (呉地正行 [日本雁を保護する会])
 |
| 写真6.呉地氏(日本雁を保護する会)による講演. |
ガン類とサギ類を対象に、集団で冬期湛水が行われている宮城県・蕪栗沼に隣接する伸萠地区と蕪栗沼周辺水田で、2005、06年度の冬期と夏期に詳細分布と行動調査を行った。ガン類は午前中は乾田や湿田を利用し、昼前後に冬期湛水水田に集中し、その後再び、乾田や湿田へ分散することが多かった。乾田では主に採食し、冬期湛水水田では休息、羽づくろい、水浴びなどが多かった。夏のサギ類は冬期湛水水田を選択的に利用した。冬期湛水水田での2年間の平均生息密度は、変動が大きいアマサギを除くと、非冬期湛水水田の3.7倍あり、アマサギを含めると4.4倍となった。また、サギ類にとって畦は重要な環境で,畦密度と個体数密度の間には正の相関が見られた。
・冬期湛水水田における冬期間のガンカモ類の夜間利用
ガンカモ類の夜間利用に着目し、その利用実態の把握と、利用目的に応じた湛水条件の解明に向けた調査も実施した。ガン類は冬期湛水水田を就塒場所または採食場所として利用したが、その例数は極めて少なかった。ハクチョウ類は、各地で就塒場所としての利用が確認された。カモ類は、冬期湛水水田を採食場所として選択的に利用し、特に水深 5-10 cm の圃場の利用が多かった。ガン類とハクチョウ類の就塒記録のある冬期湛水水田の圃場特性を整理した結果、安全性が高く、概ね水深10cm以上の湛水面が数ha以上の規模で一体的にまとまっているという条件を満たす場合に就塒場所として利用することがあると考えられた。
4. 韓国で越冬する水鳥とツル類への水田の貢献 (Sang Don LEE [韓国・梨花女子大学])
 |
| 写真7.真打ち登場!Sang Don LEE氏による講演. |
アジア諸国の水田は鳥の繁殖や越冬に重要な生息地である。韓国全土のもっとも重要な渡来地7ヵ所で越冬する鳥の個体数が1994-2002年に調査された。7ヵ所のうち4ヵ所は内陸部にあり、3ヵ所は水田が散在する沿岸部にある。総個体数から求めた面積当たりの密度は、内陸部より沿岸部の方がはるかに高かった(P < 0.004, F test)。このことは、韓国で越冬する水鳥をやしなう上で水田が重要な役割を果たしていることを示唆している(写真7)。
・絶滅危惧種ツル類の生息地としての水田
非武装地帯(DMZ)ではマナヅルとタンチョウがいっしょに越冬する。衛星追跡によってツル類は夜には非武装地帯内部、日中にはその南側にあって農業が行われている文民統制地帯(CCZ)の水田を使っていることがわかった。また、耕起された水田と耕起されていない水田を比較したところ、ツル類は耕起されていない水田をより頻繁に使っていた。さらに、2種間の競争について調べたところ、個体数密度が高いところほど移動や警戒の時間が少なく、採食に長時間費やしていた。

はじめてのDNA分析:試料採取からDNA抽出まで
近い将来 DNA 分析をしてみたい、する予定がある、だけど手始めにどういったことをしたらよいのかわからないという方は少なからずいると思います。ここでは、私が DNA 分析を始めたころに戸惑った経験をもとに、これからそうした作業を始める方の手がかりとして、基本的に必要となる準備と手法、失敗しないためのヒントを紹介したいと思います。
DNA 分析を行うためにはまず、対象種の個体から DNA を含んでいる試料(羽毛・血液・組織)を採取し、その試料を分析するまで良好な状態で保存する必要があります。また試料によっては採取に個体の捕獲が必要な場合があります。そこで、試料となる鳥類の捕獲許可申請、試料の採取方法、採取した試料の保存、DNA 抽出についてそれぞれ説明していきたいと思います。
1) 鳥類の捕獲許可申請(学術申請)
ご存じのとおり、日本では「鳥獣保護法(鳥獣の保護及び狩猟の適正化に関する法律)」という法律により、全ての野生鳥類は捕獲(損傷や卵の採取を含む)が禁止されていますので、捕獲に先立って捕獲許可申請を行う必要があります。有害鳥獣捕獲や、学術研究を目的とする場合に限り申請が許可されます。国と都道府県に野生鳥獣の捕獲許可権限があり、どのような捕獲方法をとるか、どういった場所でどのような鳥種を捕るかによって、どちらに捕獲許可申請を行うかが異なるので注意が必要です。対象種が希少鳥獣や国内希少野生動植物種に指定されている、もしくは予定している捕獲地が国設鳥獣保護区内にある、捕獲方法にかすみ網を使用するといった条件をどれか一つでも満たす場合には、国に許可権限があり、環境省の地方環境事務所に許可申請を行います。どれも満たさない場合は各都道府県に許可権限があります。手続きの詳細や必要書類は環境省地方環境事務所、各自治体の HP で入手することができます。上記以外にも、対象種や捕獲地が国や地方公共団体の天然記念物に指定されている場合は、別に文化庁や教育委員会に対して現状変更の手続きが必要となります。
申請時には申請書類の他に、どのような試料を、どのような方法で採取するか、詳しく説明する資料を添付する必要があります。捕獲の際、かすみ網以外の方法(e.g. 無双網やワナ、手捕り)を併用する場合には、同時に記載しておきます。山階鳥類研究所の標識調査の協力バンダーでも、DNA サンプルを採取するには、通常の標識許可の他に学術申請を行う必要があります。通常、申請を行ってから1ヶ月ほどで許可は下りますが、年度はじめには申請が多く、手続きに時間がかかることがありますので、春?夏の繁殖期に捕獲を考えている場合は、時間に余裕を持って2ヶ月前には申請を行っておくと安心です。
捕獲調査地が具体的に決まったら、その場所を管理している団体機関に、事前に立ち入りに関する許可をえる必要があります。捕獲許可申請よりも手続きは比較的簡便ですが、それでも許可が下りるまでに2?3日かかることがありますので、事前に行っておけばスムーズに捕獲作業を行うことができます。私はコアジサシを研究対象としているので、河原や海岸沿いに立ち入ることが多いので、港湾局や国土交通省の河川事務所に申請を行っています。
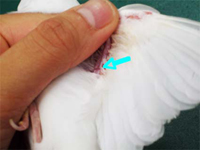 |
| 図1.翼下静脈の位置(矢印). |
生きている野鳥から DNA を採取できる最もよい試料は血液です。鳥類の赤血球は有核のため、少量の血液(1滴程度)からでも大量の DNA を得ることができます。適切な方法が採取する限り、採血が個体の健康や行動に与える影響については無視できるほど小さいことが知られています(Hoysa & Weatherhead 1991)。通常、翼下静脈から血液の採取を行います(図1)。ただし、翼下静脈からの採血は小鳥などサイズが小さく皮膚が肌色の鳥類では簡単ですが、大型の鳥や、水鳥などで皮膚が黒いものでは難しいので、代わりに首部や脚部に露出している静脈を利用することもできます。採血は、滅菌された清潔な針で露出している静脈を軽く突き、傷口から玉状に滲んでくる血液を、毛細管現象を利用して細いガラス管(ヘマトクリット毛細管)で吸い取ります。1回の採取で 20-40μl (=1滴程度)も採取できれば、その後の分析に十分です。針を深く刺しすぎると内出血してしまい、傷口から出血しなくなってしまうので、突くときはあまり力を入れすぎないのがコツです。針は市販されている注射針(小鳥類であれば直径 0.4mm 前後[28G]が適当、テルモ社製だと1箱100本入900円程度)が好んで用いられていますが、アルコール消毒を併用すれば縫い針も利用できます。注射針には割り箸などで持ち手を付けると扱いやすくなりますし(図2)、縫い針はふとん針など長いものが使いやすいです。
 |
| 図2.採血用の注射針と割り箸の柄. |
 |
| 図3.ティッシュで圧迫止血している様子. |
もし新鮮な遺体標本を手に入れることができるならば、組織を採取します。新鮮な組織は血液についで DNA 試料として優れており、少量の肉片から大量の DNA を得ることができます。採取する組織としては胸筋や肝臓が望ましいですが、腐敗した組織から得られる DNA は劣化して断片化が著しいので分析には適しません。特に肝臓は腐敗が進むスピードが速いので、少し腐敗した遺体標本から試料を採取するときは、胸筋を優先的に採取するとよいかもしれません。Christidi and Norman (2003) は死後しばらく経過した遺体標本では、肝臓よりも羽毛や足裏組織(foot pad)から質の良い DNA を含む試料を得ることができると述べています。組織採取時は病原菌などに感染するのを防ぐためゴム手袋を着用し、胸部を解剖用のハサミを用いて開いて採取を行います。採取した組織は細かく刻んだ状態でエタノール(純粋エタノール 99.5%)に保存します。このとき、組織片の量に対してエタノールが少なすぎると、脱水(dehydration)がうまくいかず、細胞中の DNA 分解酵素を十分不活性化できなくなります。結果として試料の劣化を早めてしまうので注意が必要です。目安としては、保存する組織片の10倍量以上の純粋エタノールに保存するのが望ましいと思います。私が組織採取を行うときは、2 ml のスクリューキャップチューブ(図4)に 0.1 cm3 程度の組織を採取し、チューブ内で細かく刻んだあと、純粋エタノール(99.5%)を 1.5 ml ほど入れて組織を浸します。この場合でも、エタノールの脱水効果で組織から水分が出てチューブ内のエタノール濃度が多少下がりますので、翌日に一度エタノールを新しいものに取り換えることが望ましいです。ただし、エタノールの脱水作用によって組織片内の DNA 分解酵素を完全に不活性化させることは難しいので、上記の操作をしたとしても、なるべく早いうちに DNA 抽出を行うのがよいと思います。また、長期間できるだけ良好な状態で保存するために、-80℃ のフリーザーに保管するのがよいと思います。
3) 血液試料の保存試薬について
血液を保存するために用いられている試薬で主流のものは、純粋エタノール(99.5%)、溶解緩衝液(lysis buffer)、DNA 保存用カードの大きく3種類に分けることが出来ます。生物の細胞の中にはDNA 分解酵素が含まれており、DNA の劣化を防ぐためにはこの酵素が不活性化した状態で試料を保存する必要があります。いずれの試薬も酵素を不活性化させている点は共通しますが、酵素不活性化の方法、試料の保存性、野外での使いやすさ、価格、準備にかかる手間などにそれぞれ長所短所がありますので、状況に応じて使い分けるのがよいと思います。
 |
| 図4.組織を保存するスクリューキャップチューブ(2 ml). |
溶解緩衝液(lysis buffer)は、細胞を溶解し細胞内に内包されている核酸を化学的に安定した緩衝液中に放出させることで、室温において安定した DNA の保存を可能にした試薬です。酵素の活性に必要なマグネシウムイオン(Mg2+)やカルシウムイオン(Ca2+)などをキレート化することで酵素を確実に不活化するため、試料の長期保存に非常に適しています。細胞の溶解には SDS(ドデシル硫酸ナトリウム)、キレート化のために EDTA(エチレンジアミン四酢酸)が添加されているのが一般的です。溶解緩衝液は開発がよく進んでおりいろいろな種類がありますが、鳥類の血液を保存するならば Queen’s buffer (Seutin et al. 1991)が最もよいと思います。細胞の溶解のために添加されている SDS は界面活性剤の一種で、このため溶解緩衝液は泡立ちやすい性質を持っていますので、毛細管から緩衝液に血液を移すときには、エタノールに移すときよりも注意が必要です。血液を移したらチューブをしっかり振って、血液を緩衝液とよくなじませます。緩衝液に対して血液を入れすぎると緩衝液がネバネバした状態になり、DNA 抽出の際に扱いづらくなるうえ、タンパク質の除去が困難になって純度の高い DNA を得ることが難しくなるので、Queen’s buffer には液量の 1/10 量程度までを限度に血液を保存します。Queen’s buffer は室温下で少なくとも半年間は核酸の劣化なしに血液を保存することができますが、冷蔵保管すれば長期間保存でも質の良い状態を保つことができます。ただし、Queen’s buffer を作成するには、試薬や、電子秤やスターラー、オートクレーブなどの機器が必要になりますので、自作が難しい場合は製薬企業(e.g. Roche, Qiagen)が販売している Lysis buffer キットを利用するとよいと思います。
純粋エタノールと溶解緩衝液を野外で用いる際は、日光の当たらない、なるべく涼しいところに置くようにします。DNA は紫外線によって分解されてしまうので、無用な DNA の劣化を防ぐために、太陽光にさらさないようにすることは特に大切です。
近年使用が広がってきた DNA 保存用カード(商標登録名:FTA カード,ワットマン社特許製品。価格など詳しくは HP: http://www.whatman.co.jp/product/Bio/fta.html)は、表面に細胞溶解用の試薬を含んでおり、カードに試料をアプライするだけで細胞が溶解され、カード内部の繊維に核酸を固定化し、室温で長期間、核酸を安定して保持することのできる製品です。固定化された核酸は、専用パンチでカードを打ち抜き、別売の FTA 精製試薬と TE バッファーでの洗浄操作(30分位の操作)を行うだけで、PCR のテンプレートとして用いることができます。カード表面は紫外線ガード加工も施されていますので野外での操作も比較的安心です。このカードは汎用性が高く、血液だけでなく様々な組織からも DNA を固定することができます。毛細管に採取した血液は、毛細管の末端をカードに押し当てると、自然にカードに吸収されていきます。一カ所に過剰に血液をのせるとカードの保存の限界を超えてしまうのと、血液がアプライされた面積=実験に使える回数になるので、血液はなるべく薄く広く、のばすようにカードにのせていきます。このカードの欠点としては、価格が高いこと、カードが湿度に弱く高湿度な環境では核酸の保存性があまり高くないこと、テンプレートとして使用するごとに精製・洗浄操作が必要なので、複数の実験を行う場合には面倒なことがあげられます。
以上から、安価で手軽なのは純粋エタノール(99.5%)を用いた保存だと思います。ただし、試料の長期保存を考える場合は、多少のコストはかかりますが、溶解緩衝液をお使いになることをおすすめします。どちらの保存試料でも、抽出した DNA はフリーザーで適切に保管することで半永久的に保存することができます。FTA カードは持ち運びが楽なので、遠方や海外で試料採取を考えている場合には便利なのではないかと思います。
4) DNA抽出
DNA 抽出は、まず試料を可溶化し、その後、液化した試料中に混在する DNA 以外の細胞構成成分(タンパク質等)を除去、DNA を精製する作業からなります。可溶化のステップでは、試料をタンパク質分解酵素の一種であるプロテナーゼ K (プロK)で処理し、その後、フェノール・クロロホルム法でタンパク質除去をします。最後に、エタノール沈殿法で DNA を精製して、保存用の緩衝液(TE bufferなど)に溶かします。作業に必要な試薬や細かな手順については、Carter (2000) やバイオ実験イラストレイテッド〈2〉遺伝子解析の基礎/中山広樹・西山敬人著/秀潤社などを参照ください。血液試料や組織片からのDNA抽出では、手順を間違えない限り、ほとんど失敗することはありません。
私が気をつけているのは、タンパク質の消化(分解)をよく行うことと、試料同士の混入(コンタミ)を防ぐことです。最初のステップであるタンパク質の消化をきちんと行うと、その後のフェノール・クロロホルム処理が楽になり、結果としてDNAを高純度で精製しやすくなります。だいたいの場合、プロ K 処理は 37℃ で一晩(16時間程度)、もしくは 55℃ で1時間程度処理します。溶解緩衝液に保存した試料はどちらの処理でもよく可溶化しますが、エタノール保存していた試料では 37℃ で一晩処理したほうが、タンパク質がよく分解され、あとの除去作業が楽なように思います。組織片の場合は、処理前にしっかり細かくしておくことが大切です。
溶解緩衝液試料や可溶化したあとの試料はとても粘性が高くベタベタしているので、気をつけていないと作業中にコンタミが起こりやすくなります。口径の小さいピペットを使用するときは、チップの深さも浅いので、吸い込みが悪いからといって急激に吸い取ろうとすると、ピペット内部に試料を吸い込んでしまい、コンタミ源となってしまう危険があります。ですので、すべての行程を通して、口径の広いピペット(できれば P1000 のピペット)を使い、チップの尖端を清潔なハサミなどで切って吸い口を広くする、などの工夫をし、試料はつねにゆっくりと吸い取るようにします。実験中に少しでも作業台や器具・用具のコンタミが疑わしい状況になったら、70% の消毒用エタノールでしっかりと拭き取るか、コンタミの可能性のないものに取替えるようにします。コンタミが起こることで、あとの分析すべてが台無しになってしまうので、慎重な操作をすることが大切です。
DNA 抽出は、上記に紹介した操作の他に、製薬企業が販売しているキットを利用することもできます(e.g. キアゲン社製 Dneasy Blood & Tissue kit、ロシュ・タイアグノスティック社製 High Pure PCR Template Preparation Kit など)。キットの長所は、操作が簡単なこと、必要な機器が卓上遠心機と恒温器だけでよいこと、1試料当りのコストは高くなりますが、試料数が少なければ、キットの方がトータルコストは抑えることができることです。初めて実験に取組む方はキットをお使いになるとよいと思います。
5) 最後に
上記では、これまで私が試したことのある方法について、自分の失敗経験をもとに詳しく述べました。しかし、ここで紹介した方法や試薬はごく限られており、すべてを十分に説明できたわけではありません。もっと詳しく知りたい方は、下記の引用文献を参照していただけますと幸いです。
<引用文献>
Carter (2000) General molecular biology. In: A. J. Baker (ed) Molecular methods in ecology. Pp 7-49. Blackwell Science.
Christidi, L. and Norman, J. A. (2003) DNA and the museum tradition. In: Colle, N. et al. (eds) Why museums aatter: Avian archives in an age of extinction. Bulletin of the British Ornithologist’s Club Supplement. Vol. 123A, pp 52-64.
Hoysak, D. J. and Weatherhead, P. J. (1991) Sampling blood from birds - a technique and an assessment of its effect. Condor 93(3): 746-752.
中山広樹・西山敬人(1995)バイオ実験イラストレイテッド〈2〉遺伝子解析の基礎、秀潤社
西海功(1997)DNA多型分析の生態学への応用 In: 山岸哲(編著)鳥類生態学入門?観察と研究のしかた、築地書館
Seutin, G. et al. (1991) Preservation of avian blood and tissue samples for DNA analyses. Can. J. Zool. 69: 82-90
Smith, T. B. et al. (2003) A call for feather sampling. Auk 120(1): 218-221.

編集長交代の挨拶
新しい媒体である「鳥学通信 (Ornithological Letters)」の編集長を2005年11月に創刊して以来、2期、2年3ヶ月間、務めて参りました。年4回(2月、5月、8月、11月の1日)、発行する定期号に加えて、原稿が集まり次第発行する増刊号をまじえて、おかげさまで本号まで18号を発行することができました。振り返ってみると、Ornithological Science の論文や日本鳥学会誌の記事ほど肩肘を張らずに、会員の誰もが読める、そして、書ける機関誌を目指して来たつもりですが、まだまだ至らない点が多かったと反省しています。まだ、2001年に廃刊となった鳥学ニュースの替わりとなれたかどうかはわかりません。
鳥学通信の記事は、会員から投稿で成り立っていますが、会員からの投稿数は多くはありませんでした。そのため、今のところ8割強は依頼原稿で成り立っています。今まで、大会でやりっ放しで記録が残ることが少なかった自由集会も報告として採録するようにしました。Web 編集の利点は、発行費用がかからないことと、活字では採録しにくい音声・動画を添付できること、自由にリンクが張れることにあると思います。
次号からは、中央農研の百瀬浩さんへ編集長のバトンを引き継ぎます。最後に、読者の皆さんにお願いしたいのは、日頃の鳥学上の疑問や意見、調査に便利なアイデア、おもしろい鳥の行動等、何でもよろしいので、なにかネタがありましたら、どしどし投稿していただきたいということです。また、編集部から原稿の依頼がありましたら、断らずに引き受けてください。Web 雑誌の身軽さと利点を生かして、今後とも鳥学通信が発展していくことを期待してキーボードをたたみたいと思います。

年の暮に不定期号の鳥学通信をお届けします。永田編集長の最後のおしごとということで、25日に原稿を揃えて頂き、いま私が大急ぎで組版しています。後記を書いている現在、28日夜、なんとか帰省前に発行の目処が立ちました。これで安心して帰れます。他に沢山仕事を抱えて帰るのですが、実家にはネット環境がないので、この仕事は今日中になんとかしないといけないのです。
来年から編集長が永田尚志さんから百瀬 浩さんに交代します。永田さん、二年間に渡り有り難うございました。私は留任します(泣)。(副編集長)
鳥学通信は、皆様からの原稿投稿・企画をお待ちしております。鳥学会への意見、調査のおもしろグッズ、研究アイデア等、読みたい連載ネタ、なんでもよろしいですので会員のみなさまの原稿・意見をお待ちしています。原稿・意見の投稿は、編集長の永田宛 (mailto: ornith_letters lagopus.com) までメールでお願いします。
lagopus.com) までメールでお願いします。
鳥学通信は、2月,5月,8月,11月の1日に定期号を発行します。臨時号は、原稿が集まり次第、随時、発行します。
編集・電子出版:日本鳥学会広報委員会